研究内容
様々なストレスに対する細胞応答の分子メカニズム
転写と共役したゲノム修復とその破綻によるゲノム異常発生の分子メカニズム
R-loopとは、DNA二重鎖にRNAが対合することによって生じたDNA-RNAハイブリッド二重鎖と一重鎖DNAを合わせた特殊な核酸構造のことを指します。転写が活性化しているゲノム領域ではRNAが豊富にあるため、このようなR-loopが生じやすいことが知られています。面白いことに、DNA二重鎖切断の修復の過程で、このR-loopが重要な役割を果たすことが近年の研究で分かってきました。
転写活性化領域は広大なゲノムの中でも特に重要な部位と考えられ、そのような領域に生じたDNA損傷は正確に修復することが求められます。DNA修復過程でのR-loopの存在によって、転写活性化領域であるマークとして認識され、正確な修復機構である転写共役型相同組換え修復(Transcription-Associated Homologous Recombination Repair; TA-HRR)や転写共役型末端結合(Transcription-Associated End Joining; TA-EJ)が誘導されることが明らかにしました(図1)。放射線を照射した細胞における転写共役型DNA修復機構の不全は、重篤なゲノム異常、特に染色体転座を高頻度で誘発することから、これらの修復機構が遺伝子領域において染色体転座を抑制する重要であると考えられます。現在、これらの修復機構の詳細なメカニズムと、ゲノム異常を抑制する機構の解明に取り組んでいます。

加齢性変容と疾患関連ゲノム異常の発生
疾患につながるような染色体転座はいつも遺伝子の領域、つまり転写活性化領域で起きています。それが生存選択圧による結果なのか、あるいは転写活性化領域にゲノム異常が起きやすい要因があるのか、という疑問は長年研究者の頭を悩ませてきました。私たちのこれまでの研究によって、後者、つまり転写活性化領域に特有の要因によって染色体転座が起きやすくなっているという証拠をつかみつつあります。
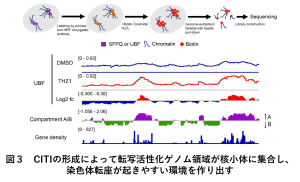
ある種のタンパク質は、特定の二次構造をとらないドメインをもち、そのような部位同士の相互作用によって起こる液―液相分離を介した集合が、細胞内の様々な現象を制御しているのではないかという仮説が近年話題となっています。私たちは、このような液液相分離によるタンパク質の集合に、染色体が巻き込まれる可能性に着目しました。そして、転写阻害ストレスに応答してある種のRNA結合タンパク質が核小体に凝集体(Condensate Induced by Transcription Inhibition; CITI)を形成すること(図2)、そしてそれらが染色体の中でも特に転写活性化領域を集合させ、染色体転座が起きやすいゲノム高次構造を形成させること(図3)をTSA-seqとよばれるゲノムワイドな解析手法によって明らかにしました。
このような凝集体CITIは、転写阻害ストレスだけでなく、低温や抗がん剤処理など、核小体にストレスが加わった様々な場面で可逆的に形成されることが分かってきており、今後は1)どのようなストレス下でCITIが形成されるのか、2)CITIの生理的な機能は何か、などについて研究を進めたいと考えています。 さらに、これらのストレス応答を加齢性の変化と関係づけて解析する取り組みを行っており、加齢によって生じてくるゲノム異常のメカニズムの解明を目指しています。

このような凝集体CITIは、転写阻害ストレスだけでなく、低温や抗がん剤処理など、核小体にストレスが加わった様々な場面で可逆的に形成されることが分かってきており、今後は1)どのようなストレス下でCITIが形成されるのか、2)CITIの生理的な機能は何か、などについて研究を進めたいと考えています。 さらに、これらのストレス応答を加齢性の変化と関係づけて解析する取り組みを行っており、加齢によって生じてくるゲノム異常のメカニズムの解明を目指しています。
がんや胎児の染色体異常症などの疾患の発生機序
染色体転座によって生じる疾患は、がんが代表的ですが、他にも精神神経疾患のリスク因子となったり、生殖細胞に生じた場合には不妊や胎児の染色体異常症を引き起こします。このような疾患の背景にある根源的な分子メカニズムの理解を目指すことは、疾患に対する新たな予防・治療戦略の開発につながると考えています。特に昨今問題となっている高齢出産や生殖医療における問題の機序解明や、がんの治療、根絶戦略の開発を念頭に、長寿社会における諸問題の解決への貢献につながることを期待して研究を進めています。
